真菌由来の毒素「サイトカラシンD」がアクチンに働きかける新たな仕組みを発見!-細胞の"骨格"を制御するメカニズムに迫る-
2025.07.15
ポイント
- 真菌由来の毒素サイトカラシンD(※1)は世界中のアクチン(※2)関連研究で長年使われている重要な試薬
- サイトカラシンDがアクチンに"ふた"をする仕組みを、分子レベルのリアルタイム観察で解明
- サイトカラシンDがアクチンを切断する、細胞の動きの制御につながる新しい作用を発見
概要
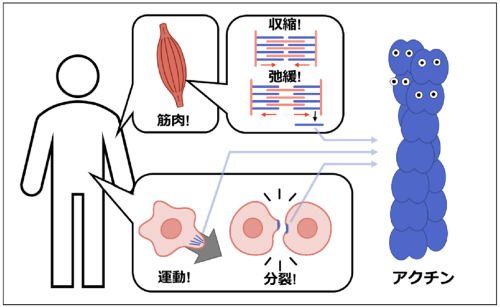
長岡技術科学大学大学院工学研究科博士後期課程先端工学専攻の三谷隆大さん(大学院生)、同大学技学研究院物質生物系の藤原郁子准教授、本多元名誉教授、名古屋大学大学院情報学研究科の武田修一研究員、前田雄一郎名誉教授、同大学大学院理学研究科の成田哲博准教授、東海学院大学健康福祉学部の小田俊郎教授の研究グループは、真菌が作る毒素「サイトカラシンD (Cytochalasin D)」が、「アクチン」(図1)に作用する新たなメカニズムを明らかにしました。アクチンは、筋肉の収縮や細胞の運動や形づくり、分裂に欠かせないタンパク質です。この成果は、がんの転移や免疫の仕組みなど、細胞の"動き"が鍵となる生命現象の理解や制御につながる知見であり、将来的な創薬や医療技術の開発への応用も期待されます。
用語解説
※1 サイトカラシンD
真菌の二次代謝産物。アクチンフィラメントのB端に強く結合して重合・脱重合を阻害します。また高濃度ではアクチンフィラメントを切断する作用をもち(本研究で初めて可視化された)、細胞の運動や形態形成に関与するアクチンの機能を妨げます。
※2 アクチン
筋肉の主要構成成分として発見された後、動物・植物・酵母などあらゆる真核細胞に存在することが分かっています。筋収縮だけでなく、細胞分裂時の収縮環形成、細胞の変形・移動、細胞内輸送、核内構造の維持や転写制御など、きわめて多様な生命現象に関与する、生命に必須のタンパク質です。
論文情報
論文タイトル:Microscopic and structural observations of actin filament capping and severing by Cytochalasin D
著者:三谷隆大、武田修一、小田俊郎、成田哲博、前田雄一郎、本多元、藤原郁子
掲載誌:Proceedings of the National Academy of Sciences of the United States of America(PNAS)
掲載日:2025年7月14日
DOI:10.1073/pnas.2502164122
研究内容の詳細(プレスリリース本文)
本学の研究者
大学院工学研究科 博士後期課程 先端工学専攻 三谷隆大さん(大学院生)
技学研究院 物質生物系 藤原郁子 准教授
本多元 名誉教授
